GB9706.1-2020基本安全和基本性能|医用电气设备与医疗器械的边界与合规攻略
本文从“医用电气设备”与“医疗器械”的根本差异谈起,系统解读GB9706.1-2020基本安全和基本性能的识别、验证与申报要点,帮助研发、法规与质量团队在项目早期就把握住监管脉络,降低返工与认证不确定性。作为医疗器械注册咨询机构,我们将以风险管理为主线,把标准条款翻译成落地做法,让每一项设计与测试都对证合规闭环。
医用电气设备与医疗器械:到底差在哪儿
- 医疗器械是“大概念”。它既包含完全不带电的产品(如眼镜、避孕套、植入体等),也包含需要电源驱动的装置。是否“通电”不是医疗器械的必要条件。
- 医用电气设备是“医疗器械”中的一个子集,具备两大特征:
- 与供电系统存在不多于一个连接(如电源线、内置或外置供电模块);
- 制造商声称用于对患者的诊断、治疗或监护,或者用于减轻疾病、伤害或残疾。像电动轮椅、心电监护仪、呼吸机等就落入该范畴,而普通眼镜就不是医用电气设备。
通俗说法:所有医用电气设备都是医疗器械,但并非所有医疗器械都是医用电气设备。把设备是否“有源”“接电”与是否承担诊疗/监护临床功能两件事同时满足,基本就能判定它是否属于医用电气设备。
标准框架一图读懂:通标、并列与专标
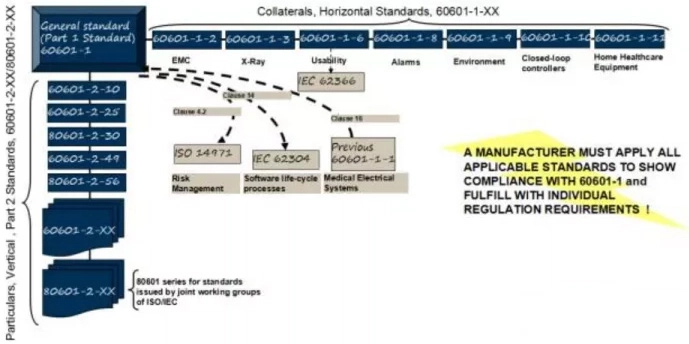
- 通用标准:IEC 60601-1(在国内对应GB 9706.1)。第三版开始将“安全”扩展为“基本安全+基本性能”,并把风险管理、软件与可用性纳入体系化要求。
- 并列(横向)标准:
- 60601-1-2 电磁兼容(EMC);
- 60601-1-6 可用性工程(与IEC 62366耦合);
- 60601-1-11 家用医疗环境要求。
它们为不同使用场景与人因风险提供横向约束。
- 专用(特定)标准:60601-2-XX/80601-2-XX,面向具体品类(如心电、无创血压、X射线、CT、乳腺机、经皮神经电刺激等),在通标基础上提出更细的基本安全与基本性能要求。
国内外版本对应:
- GB9706.1-2020已发布并实施,整体等同对齐IEC 60601-1第三版序列(含后续修订);当前国际通行的为IEC 60601-1:2015 + A1:2020(俗称3.2版)。
- EMC方面,我国曾用YY 0505-2012,现由YY 9706.102-2021替代并实施;国际对应的为IEC 60601-1-2:2014 + A1:2020(第4.1版),抗扰度和试验门槛显著提高。
以上映射非常关键:决定了你应采用哪一版条款、测试水平与型式试验接受准则,直接影响选型、布局与认证计划。
“基本安全”与“基本性能”:第三版的核心增量
- 基本安全(Basic Safety):从电击、机械、热、辐射、火灾等角度确保设备在正常与单一故障条件下不致造成不可接受风险。第三版将风险管理整合进通标逻辑,强调“安全是由设计与验证共同达成的结果”,而非仅靠末端测试兜底。
- 基本性能(Essential Performance):第三版新增并反复迭代定义,最终确立为“与基本安全无关的临床功能的性能;当其超出制造商规定的限值发生降级或丧失时,会导致不可接受风险”。换句话说,临床功能性的“失真/失效”本身也能变成安全问题。
这些变化使设备合规从“合格不等于安全”走向“功能可用、风险受控且可证明”。尤其是基本性能,要求制造商明确限值、故障情境与残余风险接受标准,并在试验中按此判定达标/失效。
基本性能从何而来:定义沿革与落地逻辑
- 历史沿革:
- 早在IEC 60601-1-2:2001就出现雏形;
- IEC 60601-1:2005(3.0)给出“为实现免于不可接受风险所需的性能”的表述;
- IEC 60601-1:2012(3.1)进一步明确“临床功能性能+超限即不可接受风险”的现代定义,并延续至3.2体系。
- 方法论转向:从“硬安全指标”(绝缘、间隙、爬电距离、温升等)扩展到“临床功能可用性”的系统安全观;风险管理成为识别基本性能的总入口。
示例一览:
- 输注设备的剂量/流速准确性;
- 心电设备在除颤后能否快速恢复波形识别;
- ICU/手术部位监护系统的报警有效性;
- 用于诊断的设备给出结果的正确性(错误结果可引发不当治疗)。
并非所有设备都必须有基本性能。若某类设备的任何临床功能降级都不会引发不可接受风险(结合制造商的风险准则),则“无基本性能”亦是合法的识别结果,如有些医用床即无专标条款定义基本性能。
如何区分并判定“这项功能是不是基本性能”
- 三问框架:
- 与基本安全有关吗?如果是(如基础绝缘),就不是基本性能;
- 它是临床功能吗?如果不是(如音频娱乐),就不是基本性能;
- 是否存在明确限值,且低于限值会造成不可接受风险?若是,则可判定为基本性能。
- 专标优先:若产品有相应专用标准,请优先参考201.4.3条款中对基本性能的明示,如婴儿培养箱要求把皮温与空气温度超限报警作为基本性能;其背后逻辑是即便温控能力短时偏离,报警能为护理人员争取处置窗口,避免不可接受风险。
- 无专标场景:以风险分析为依据进行主动识别,形成“功能-限值-风险”矩阵并进入RMF记录,可判定“有/无基本性能”两种结论。

请注意,报警是“功能”,而“报警性能”(如阈值、响应时间)才可被定义为基本性能指标。以呼吸机为例,将“氧压低于X且持续3秒必须报警”的时限要求,视为具有限值的报警性能指标。
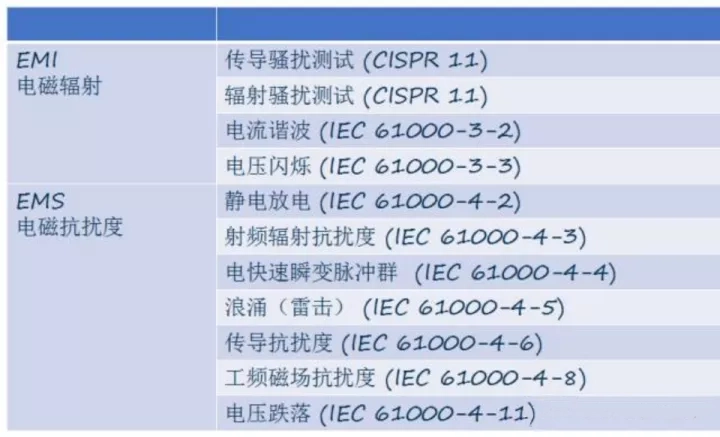
EMC与基本性能:接受准则如何落在纸面
- 试验依据:按照通标和专标逐条测试,但在“判定合格”时必须使用制造商定义的基本性能与限值作为接受准则,联合评估在EMI/EMS干扰下设备是否仍维持基本性能不丧失或不超限。
- 版本跃迁:第4.1版EMC在静电放电、辐射抗扰度等方面提升门槛,同时明确以风险分析决定试验等级与工作模式,逼近真实临床场景,避免“实验室合格、临床崩盘”的脱节。
- 使用环境分级:专业医疗、家庭健康、特殊环境(MRI、军工、重工业)等,对抗扰度等级与功能接受准则会有差异。请在RMF中把“使用环境→外部扰动→基本性能影响”链条闭环化。
版本与术语对齐:注册路线要选准“赛道”
- GB9706.1-2020与IEC 60601-1第三版(含修订)对齐,国内实施日期明确,建议研发文档、标识、警示语与说明书同步更新第三版术语体系及风险导向要求,避免“老版安全观”与“新版功能安全观”混搭造成的资料驳回。
- EMC从YY 0505-2012更新到YY 9706.102-2021后,测试项、等级与工作模式覆盖更严,务必提前在样机阶段做预扫描与抗扰设计,减少送检返工。
设计输入:把“基本安全+基本性能”写进需求
- 立项即并行:在URS/系统需求中同步放入基本安全与基本性能要求,明确限值、工作模式、失效工况与报警策略,避免后期“先天缺陷”无法靠补丁补齐。
- 风险管理为骨架:用ISO 14971思路拉通危害→危险情况→伤害→风险矩阵→控制措施→验证与残余风险。基本性能的“限值与接受准则”应来源于此框架,而不是事后口头约定。
- 软硬协同:软件安全(IEC 62304)与可用性工程(IEC 62366)是实现基本性能稳定性的必做功。界面、报警优先级、确认/抑制逻辑、人因误操作,都可能成为基本性能的“软风险”来源。
验证与确认:把试验做在“失效点”之前
- 设计验证:在正常、极限与单一故障条件下验证基本性能不超限。必要时进行故障注入(阈值漂移、传感器失步、供电毛刺),记录触发点与恢复行为。
- EMC验证:用“工作模式×干扰类型×接受准则”矩阵计划试验,重点观察报警、控制闭环、关键算法在扰动中的稳定性与可恢复性。
- 生产一致性:将关键限值与报警策略固化到型式检验依据与过程控制计划中,形成“设计—试验—生产—市场反馈”的闭环。
申报资料:把“识别—限值—验证”讲清楚
- 关键交付物:
- 基本性能识别清单(含限值、触发条件、不可接受风险说明);
- 风险管理文件(RMF)含控制措施与验证证据;
- 通标/并标/专标的测试报告,EMC报告明确采用的基本性能接受准则;
- 软件与可用性合规文件(如适用)。
- 有/无基本性能都可接受:前提是判定过程可溯源、基于风险,且与专标条款不冲突。例如某些医用床无201.4.3条款定义基本性能,说明其失效不致触发不可接受风险,而非其“没有功能”。
常见误区与规避建议
- 仅把基本性能当“产品卖点参数”。纠偏:它是“关系到风险”的临床功能参数,必须有限值、有验证、有接受准则。
- EMC只看“没死机”。纠偏:要看“在扰动下基本性能是否仍满足限值”,尤其报警与控制闭环的行为边界。
- 参照老报告生搬硬套。纠偏:第三版之后的“功能安全观”要求文档逻辑、试验设计与接受准则整套升级。
- 忽略专标201.4.3。纠偏:一旦专标定义了基本性能,制造商自定义不得与之冲突,应据此细化试验与限值。
一表看清:医用电气设备 vs 医疗器械(要点对比)
| 维度 | 医疗器械(大集合) | 医用电气设备(子集) |
|---|---|---|
| 是否必须通电 | 否。可为无源产品(如眼镜、避孕用品、植入体等) | 是。通常需与供电系统存在不多于一个连接 |
| 核心用途 | 诊断、治疗、监护、补偿、缓解等 | 侧重以电气方式实现诊断/治疗/监护 |
| 适用通用体系 | 多元(含非电气类标准体系) | 60601-1通标 + 并列标准 + 专用标准 |
| 基本性能是否必有 | 视风险而定,可无 | 需基于风险识别;可有可无,但过程必须完备 |
| EMC要求 | 视产品类别/环境 | 强制适配60601-1-2版本要求与接受准则 |
注:判定与示例依据IEC 60601系列及其在GB/YY体系的等效采用与行业共识。
结语:把“功能即安全”的逻辑,落在每一次设计抉择上
GB9706.1-2020基本安全和基本性能的价值,在于督促制造商把临床功能与安全风险捆绑评估,把“会不会伤人”和“能不能用好”同时纳入设计目标与验证准则。我们建议企业在立项即识别基本性能、设定限值、规划EMC接受准则,并在RMF中闭环论证。这样做不仅缩短送检与注册路径,也是在为真实医疗器械临床环境的“不确定性”提前买保险。
我们能为你做到
- 基本性能识别与限值工作坊(跨研发/临床/法规快速定稿);
- EMC策略与接受准则设计(4.1版适配与预评估);
- 专标差距梳理与测试路线图(含201.4.3条款落地);
- RMF撰写与检测机构预审对接(减少来回补件)。
给我们一个需求评审会,我们给你一套可被监管与第三方实验室认可的“功能—限值—验证”闭环方案。
参考依据说明
本文关键信息(术语、定义沿革、标准框架、版本映射、EMC环境分级、基本性能判定方法与示例、专标201.4.3应用、婴儿培养箱与医用床案例等)均依据行业常用解释或相关的标准,尽量确保表达信息一致。